 |
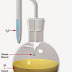
| Gambar alat instrumen GC |
GC menggunakan gas sebagai gas pembawa/fase geraknya.
Ada 2 jenis kromatografi gas, yaitu :
Ada 2 jenis kromatografi gas, yaitu :
- Kromatografi gas–cair (KGC) yang fase diamnya berupa cairan yang diikatkan pada suatu pendukung sehingga solut akan terlarut dalam fase diam.
- Kromatografi gas-padat (KGP), yang fase diamnya berupa padatan dan kadang-kadang berupa polimerik.(4)
SISTEM PERALATAN KROMATOGRAFI GAS (GC)
2. ruang suntik sampel;
3. kolom yang diletakkan dalam oven yang dikontrol secara termostatik;
4. sistem deteksi dan pencatat (detektor dan recorder); serta
5. komputer yang dilengkapi dengan perangkat pengolah data.
1. Fase gerak
Fase gerak pada GC juga disebut dengan gas pembawa karena tujuan awalnya adalah untuk membawa solut ke kolom, karenanya gas pembawa tidak berpengaruh pada selektifitas. Syarat gas pembawa adalah: tidak reaktif; murni/kering karena kalau tidak murni akan berpengaruh pada detektor; dan dapat disimpan dalam tangki tekanan tinggi (biasanya merah untuk hidrogen, dan abu-abu untuk nitrogen) 4).
2. Ruang suntik sampel
Lubang injeksi didesain untuk memasukkan sampel ecara cepat dan efisien. Desain yang populer terdiri atas saluran gelas yang kecil atau tabung logam yang dilengkapi dengan septum karet pada satu ujung untuk mengakomodasi injeksi dengan semprit (syringe). Karena helium (gas pembawa) mengalir melalui tabung, sejumlah volume cairan yang diinjeksikan (biasanya antara 0,1-3,0 μL) akan segera diuapkan untuk selanjutnya di bawa menuju kolom. Berbagai macam ukuran semprit saat ini tersedia di pasaan sehingga injeksi dapat berlangsung secara mudah dan akurat. Septum karet, setelah dilakukan pemasukan sampel secara berulang, dapat diganti dengan mudah. Sistem pemasukan sampel (katup untuk mengambil sampel gas) dan untuk sampel padat juga tersedia di pasaran(1).
Pada dasarnya, ada 4 jenis injektor pada kromatografi gas, yaitu:
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan diuapkan dalam injector yang panas dan 100 % sampel masuk menuju kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan diuapkan dalam injector yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua sampel diuapkan dalam injector yang panas dan dibawa ke dalam kolom karena katup pemecah ditutup; dan
d. Injeksi langsung ke kolom (on column injection), yang mana ujung semprit dimasukkan langsung ke dalam kolom.
Teknik injeksi langsung ke dalam kolom digunakan untuk senyawa-senyawa yang mudah menguap; karena kalau penyuntikannya melalui lubang suntik secara langsung dikhawatirkan akan terjadi peruraian senyawa tersebut karena suhu yang tinggi atau pirolisis(2).
3. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di dalamnya terdapat fase diam. Oleh karena itu, kolom merupakan komponen sentral pada GC.
Ada 3 jenis kolom pada GC yaitu kolom kemas (packing column) dan kolom kapiler (capillary column); dan kolom preparative (preparative column). Perbandingan kolom kemas dan kolom kapiler dtunjukkan oleh gambar berikut :
 |
| Kolom Kemas Kolom Kapiler |
Fase diam yang dipakai pada kolom kapiler dapat bersifat non polar, polar, atau semi polar. Fase diam non polar yang paling banyak digunakan adalah metil polisiloksan (HP-1; DB-1; SE-30; CPSIL-5) dan fenil 5%-metilpolisiloksan 95% (HP-5; DB-5; SE-52; CPSIL-8). Fase diam semi polar adalah seperti fenil 50%-metilpolisiloksan 50% (HP-17; DB-17; CPSIL-19), sementara itu fase diam yang polar adalah seperti polietilen glikol (HP-20M; DB-WAX; CP-WAX; Carbowax-20M) (6).
4. Detektor
Komponen utama selanjutnya dalam kromatografi gas adalah detektor. Detektor merupakan perangkat yang diletakkan pada ujung kolom tempat keluar fase gerak (gas pembawa) yang membawa komponen hasil pemisahan. Detektor pada kromatografi adalah suatu sensor elektronik yang berfungsi mengubah sinyal gas pembawa dan komponen-komponen di dalamnya menjadi sinyal elektronik. Sinyal elektronik detektor akan sangat berguna untuk analisis kualitatif maupun kuantitatif terhadap komponen-komponen yang terpisah di antara fase diam dan fase gerak.
Pada garis besarnya detektor pada KG termasuk detektor diferensial, dalam arti respons yang keluar dari detektor memberikan relasi yang linier dengan kadar atau laju aliran massa komponen yang teresolusi. Kromatogram yang merupakan hasil pemisahan fisik komponen-komponen oleh GC disajikan oleh detektor sebagai deretan luas puncak terhadap waktu. Waktu tambat tertentu dalam kromatogram dapat digunakan sebagai data kualitatif, sedangkan luas puncak dalam kromatogram dapat dipakai sebagai data kuantitatif yang keduanya telah dikonfirmasikan dengan senyawa baku. Akan tetapi apabila kromatografi gas digabung dengan instrumen yang multipleks misalnya GC/FT-IR/MS, kromatogram akan disajikan dalam bentuk lain.
Beberapa sifat detektor yang digunakan dalam kromatografi gas adalah sebagai berikut :
Jenis
Detektor
|
Jenis Sampel
|
Batas Deteksi
|
Kecepatan
Alir (ml/menit)
|
||
Gas Pembawa
|
H2
|
Udara
|
|||
Hantaran panas
|
Senyawa umum
|
5-100 ng
|
15-30
|
-
|
-
|
Ionisasi nyawa
|
Hidrokarbon
|
10-100 pg
|
20-60
|
30-60
|
200-500
|
Penangkap
elektron
|
Halogen organic,
pestisida
|
0,05-1 pg
|
30-60
|
-
|
-
|
Nitrogen-fosfor
|
Senyawa nitrogen organik
dan fospat organic
|
0,1-10 g
|
20-40
|
1-5
|
700-100
|
Fotometri nyala
(393 nm)
|
Senyawa-senyawa
sulfur
|
10-100 pg
|
20-40
|
50-70
|
60-80
|
Fotometri nyala
(526 nm)
|
Senyawa-senyawa fosfor
|
1-10 pg
|
20-40
|
120-170
|
100-150
|
Foto ionisasi
|
Senyawa yang
terionisasi dg UV
|
2 pg C/detik
|
30-40
|
-
|
-
|
Konduktivitas
elektrolitik
|
Halogen, N, S
|
0,5 pg C
12 pg S
4 pg N
|
20-40
|
80
|
-
|
Fourier Transform-inframerah
(FTIR)
|
Senyawa-senyawa
organik
|
1000 pg
|
3-10
|
-
|
-
|
Selektif massa
|
Sesuai untuk senyawa
apapun
|
10 pg-10 ng
|
0,5-30
|
-
|
-
|
Emisi atom
|
Sesuai untuk elemen
apapun
|
0,1-20 pg
|
60-70
|
-
|
|
Komponen GC selanjutnya adalah komputer. GC modern menggunakan komputer yang dilengkapi dengan perangkat lunaknya (software) untuk digitalisasi signal detektor dan mempunyai beberapa fungsi antara lain:
- Memfasilitasi setting parameter-parameter instrumen seperti: aliran fase gas; suhu oven dan pemrograman suhu; serta penyuntikan sampel secara otomatis.
- Menampilkan kromatogram dan informasi-informasi lain dengan menggunakan grafik berwarna.
- Merekam data kalibrasi, retensi, serta perhitungan-perhitungan dengan statistik.
- Menyimpan data parameter analisis untuk analisis senyawa tertentu(4).
Derivatisasi merupakan proses kimiawi untuk mengubah suatu senyawa menjadi senyawa lain yang mempunyai sifat-sifat yang sesuai untuk dilakukan analisis menggunakan kromatografi gas (menjadi lebih mudah menguap). Alasan dilakukannya derivatisasi:
- Senyawa-senyawa tersebut tidak memungkinkan dilakukan analisis dengan GC terkait dengan volatilitas dan stabilitasnya.
- Untuk meningkatkan batas deteksi dan bentuk kromatogram. Beberapa senyawa tidak menghasilkan bentuk kromatogram yang bagus (misal puncak kromatogram saling tumpang tindih) atau sampel yang dituju tidak terdeteksi, karenanya diperlukan derivatisasi sebelum dilakukan analisis dengan GC.
- Meningkatkan volatilitas, misal senyawa gula. Tujuan utama derivatisasi adalah untuk meningkatkan volatilitas senyawa-senyawa yang tidak mudah menguap (non-volatil). Senyawa-senyawa dengan berat molekul rendah biasanya tidak mudah menguap karena adanya gaya tarik-menarik inter molekuler antara gugus-gusug polar karenanya jika gugus-gugus polar ini ditutup dengan cara derivatisasi akan mampu meningkatkan volatilitas senyawa tersebut secara dramatis.
- Meningkatkan deteksi, misal untuk kolesterol dan senyawa-senyawa steroid.
- Meningkatkan stabilitas. Beberapa senyawa volatil mengalami dekomposisi parsial karena panas sehingga diperlukan derivatisasi untuk meningkatkan stabilitasnya.
- Meningkatkan batas deteksi pada penggunaan detektor tangkap elektron (ECD).
Caranya :
Sirup dekongestan dibasakan dengan amonia dan diekstraksi ke dalam etil asetat sehingga akan menjamin bahwa semua komponen yang terekstraksi berada dalam bentuk basa bebasnya daripada bentuk garamnya. Bentuk basa inilah yang bertanggungjawab pada bagusnya bentuk puncak kromatografi. Garam-garam atau basa-basa akan terurai karena adanya panas pada lubang suntik GC, sehingga dengan adanya proses ini akan dapat menyebabkan terjadinya peruraian.
Jika ekstrak pada sirup dekongestan di lakukan kromatografi gas secara langsung maka kromatogram yang dihasilkan seperti gambar dibawah. Basa bebas triprolidin dan dekstrometorfan menunjukkan bentuk puncak yang bagus, akan tetapi pesudoefedrin yang merupakan basa yang lebih kuat karena adanya gugus hidroksil dan gugus amin memberikan bentuk puncak yang kurang bagus. Hal ini dapat diatasi dengan menutup gugus polar (gugus hidroksi dan amin) pada pseudoefedrin dengan cara mereaksikannya menggunakan trifluoroasetat anhidrida (TFA). Perlakuan dengan TFA ini tidak menghasilkan senyawa derivatif terhadap senyawa-senyawa basa tersier dalam ekstrak (sirup dekongestan) ini. Reagen TFA ini sangat bermanfaat karena reagen ini sangat reaktif dan bertitik didih rendah (400C) sehingga kelebihan reagen TFA ini mudah dihilangkan dengan cara evaporasi sebelum dilakukan kromatografi gas.
Ini kromatogram sebelum dilakukan derivatisasi......
Yang ini kromatogram sesudah derivatisasi......
Pustaka:- Kenkel, J., 2002, Analytical Chemistry for Technicians, 3th. Edition., CRC Press, U.S.A.
- Grob, R.L., 1995, Modern Practice of Gas Chromatography, 3th Ed., Jhon Wiley and Sons, New York.
- Settle, F (Editor), 1997, Handbook of Instrumental Techniques for Analytical Chemistry, Prentice Hall PTR, New Jersey, USA.
- Kealey, D and Haines, P.J., 2002, Instant Notes: Analytical Chemistry, BIOS Scientific Publishers Limited, New York.
- Watson, D.G., 1999, Pharmaceutical Analysis: A textbook for pharmacy students and pharmaceutical chemists, Churchill Livingston, UK.
- Adamovics, J.A., 1997, Chromatographic Analysis of Pharmaceuticals, 2nd Edition, Marcel Dekker, New York.















20 comments:
walaupun dari blog, ini sumbernya buku2 kan yah..
ehe,,
izin jadi referensi buat laporan
thanks gan.. bermanfaat jg sbg salah satu refrensi buat presentasi
hmmm...gomawo..telah membantu saya dalam presentasi kali ini..
blogwalking gan, blognya sangat informatif, baik buat pemula seperti sy. thanks.
mbak saya dari mahasiswa kedokteran hewan unair, mbak mau tanya kalo mau meriksa residu dioksin dengan hplc atau gc yah?? itu biayanya berapa per sampel susu??
Uji dioksin menggunakan GC. Akan tetapi kami tidak mempunyai senyawa standar dioksin (dioxin), jadi analisis tidak bisa dilakukan.
Maaf apa alat ini bisa untuk mengukur konsentrasis suatu gas, semisal berapa ppm gas co pada bensin
GC bisa digunakan untuk analit yang terdapat dalam sample yang bisa diuapkan. Jadi untuk mengukur CO dalam bensin sangat bisa sekali (menggunakan kolom yang sesuai), bensin akan dirubah terlebih dahulu menjadi fase uap (di dalam sistem injector). Detektor yang digunakan adalah FID-metanazier. Gas CO akan di mixing dengan H2 sehingga CO akan berubah menjadi CH4.. Tentunya setiap melakukan analisa memerlukan standard analit yang akan di analisa.
bagaimana cara pemakaian kolom kapiler pada gc?
Pemakaian kolom kapiler tidak ada bedanya dengan kolom kemas. Perbedaan hanya pada koefisiensi kinerja. Perbedaan lain pd panjang kolom kapiler hingga lebih dari 25 meter sedang kolom kemas hanya beberapa mtr saja. Fase diam kolom kapiler jika sudah rusak tidak bisa diperbaiki, sedang kolom kemas bisa diganti isi fse diam.
Pengen nanya,syarat2 gas yang digunakan utk instrument GC apa saja y..? Krn d tempat saya menggunakan UDT atau compress air dr compressor plant, memang sdh d pasang zero air dan mouisture trap cm tkt ja klu ada syarat2 yg lain slain dr bebas air dan kemurniannya, shga dpt merusak instrument GC. Makasih. Mohon penjelasannya.
Gas yang direkomendasikan pd kemurnian 99,9995%, kualitas udara zero grade. Selain zero air & moisture trap, silahkan pasang oksigen trap & hydrocarbon trap.
pengen nanya, apa yg menjadi penyebab tidak terbaca puncak2 pada kromatogram, padahal kromatogram tsb memberikan puncak. makasih
Semua peak akan selalu terbaca kecual jika baseline puncak jelek atau setting minimum area dibuat lebih tinggi daripada peak yang tidak terbaca tadi. Operator GC akan selalu memprogram minimum area, jika tidak maka semua peak akan terbaca sehingga menyebabkan printout area terlalu banyak.
maaf sy mau tanya, knapa hasil uji (etanol) sy luas areanya hrus dibagi dgn luas area propanol? sbenarnya apa peran propanol tsb? mks
Uji kadar ethanol tetap menggunakan kurva standar ethanol juga untuk menghitung kadar. Pembagian dengan area propanol tidak ada dasarnya. Semua perhitungan concentrasi harus tetap menggunakan standar pembanding yang sama dengan parameter yang diuji.
kaka bantu aku dunk . gimana cara perhitungan.a GC itu . aku kmren ne KKP di balai besar BPOM padang dan menggunakan alat GC . jdul laporan ku penetapan kadar etanol , metanol dan isopropanol dalam kosmetik secara aerosol dalam GC kaka . gimana cra perhitugan.a sampel yg positif dan negatif . mksih dn mohon bantu aku :( .
Silahkan dicek peak di kromatogram yg mempunyai waktu retensi yang sama dengan etanol, metanol, iso propanol. Ketiganya mempunyai waktu retensi di awal. Masukkan area masing2 ke dalam perhitungan regresi standar ketiga solvent tsb. Hasil yg didapat dibagi dengan volume injeksi kalikan 100% sama dg kadar etanol, dst.
Perhitungan regreai standar solvent nya diperoleh dr mana ya?
Regresi diperoleh dengan cara membuat kurva pengenceran, minimal 5 titik, kemudian dinjeksikan. Data area yang diperoleh untuk menghitung rumus regresi linier Y=a+bx. Y sebagai area, x sebagai konsentrasi.
Posting Komentar